Průkopnická studie odhalila, že DNA vaše maminky a táta nepřenášejí pouze délku telomer, ale v prvních dnech života ji aktivně přetvářejí, což ovlivňuje, jak stárneme a naše riziko rozvoje nemocí, jako je rakovina.
Telomery jsou opakující se sekvence DNA na koncích chromozomů, které, stejně jako plastové tipy na koncích tkanic, chrání před rozpadajícím se a opotřebením a slzou našich genetických informací. Pokaždé, když se buňka dělí a DNA se replikuje, tyto ochranné čepice se trochu zkrátí a nakonec dosáhnou bodu, kdy se zastaví buněčné dělení. Tento stav, nazývaný buněčný stárnutí, byl spojen s nemocemi, jako je rakovina.
Vědci tradičně věří, že délka telomery je buď polygenní vlastností, kontrolovaná více geny, nebo je předávána přímo potomkům prostřednictvím rodičovských spermií a vaječných buněk. Vědci z University of Pennsylvania (UPENN) se však snaží pochopit, jak je délka telomer zděděna, zjistili, že je třeba zvážit další faktor. „Účinek originu rodičů“ ovlivňuje to, jak jsou telomery aktivně prodlouženy nebo zkráceny během časného embryonálního vývoje.
„Chtěli jsme se zeptat, jak jsou Telomeres skutečně zděděni,“ řekl Michael Lampson, PhD, profesor biologie na Upenn’s School of Arts and Sciences, a souběžný autor studie. „Je to jen telomerová sekvence DNA, kterou zdědíte od svých rodičů, nebo je to určeno geny, které regulují telomery? To, co jsme zjistili, se úhledně nehodí do žádné krabice.“
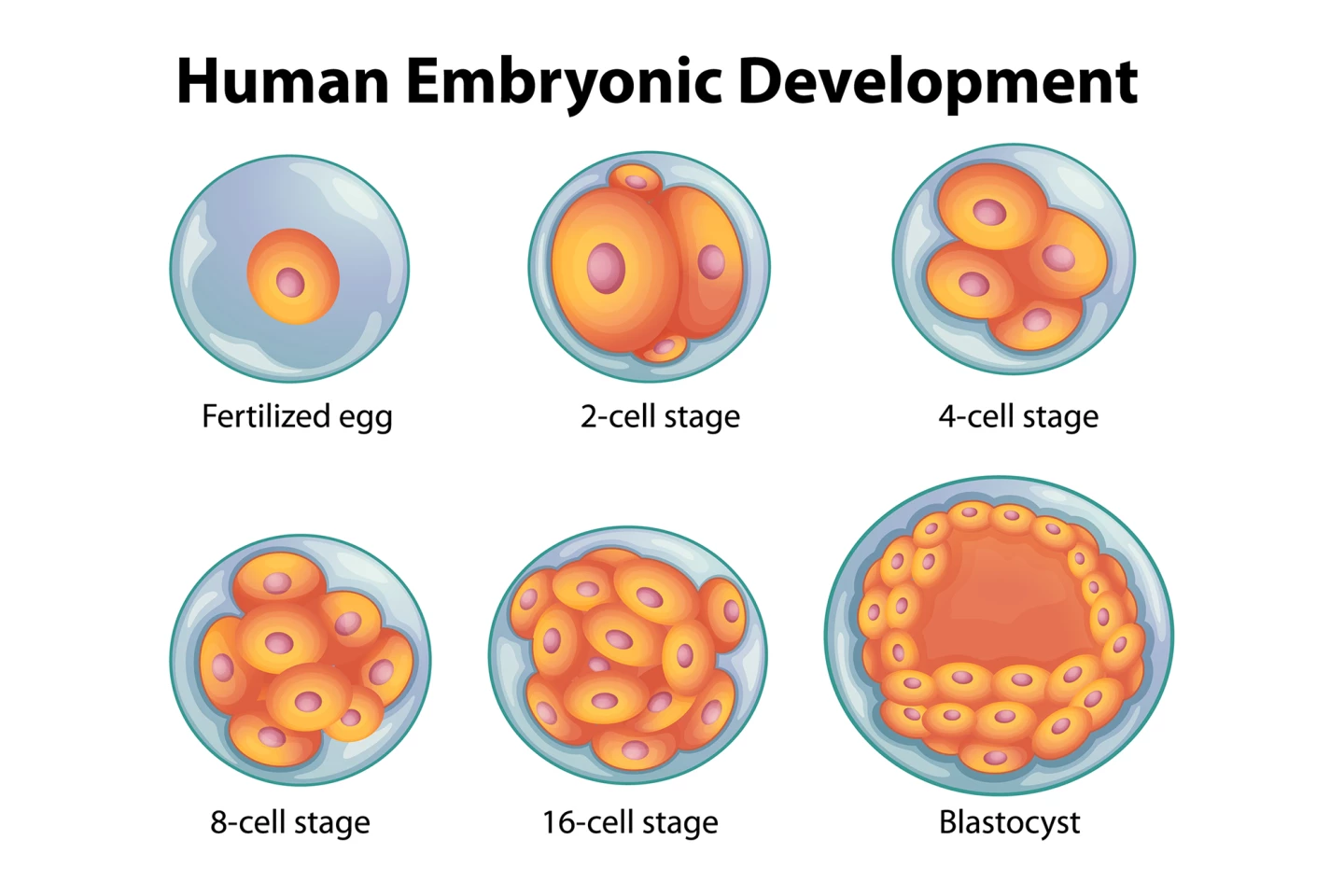
Provádějící kontrolované experimenty u myší vědci překročili kmeny s velmi odlišnými délkami telomer (dlouhé vs krátké) v obou směrech. Například otcové s dlouhými telomery s matkami krátkých telomerů a naopak. Měřili délku telomer v embryích, od dvoubuněčného stádia dále a u dospělých potomků pomocí techniky zobrazování DNA zvané ryby (fluorescenční hybridizace in situ), která rozsvítí telomery, aby mohla být jejich délka měřena pod mikroskopem. Embryo se dvěma buňkami je velmi rané embryonální stadium, kde se původní oplodněné vejce (zygote) rozdělilo do dvou odlišných buněk (blastomerů), které se nadále dělí. Vědci také hledali molekulární příznaky procesu zvaného alternativní prodloužení telomerů (ALT), mechanismu prodlužování telomeru, který se nespoléhá na obvyklý enzym, telomerázu.
Telomeráza obvykle přidává DNA do telomerů, čímž pomáhá udržovat jejich délku. Přestože většina buněk přestane produkovat telomerázu po časném vývoji, mnoho rakovinných buněk ji může reaktivovat. Většina rakovin (85% až 90%) používá reaktivovanou telomerázu k dosažení neomezeného dělení buněk, které je potřebné pro růst nádoru a překonává normální limity zamířené na replikaci buněk. ALT je zřetelný, alternativní mechanismus, který některé buňky používají k rozšíření telomerů pomocí rekombinace DNA místo telomerázy. Používá se menšinou rakovin, zbývajících 10% až 15%, k dosažení neomezené proliferace.
„Tento efekt rodičů z původu je v souladu se vzory, které jsme viděli ve studiích lidí,“ uvedla docentka biologie UPENN, Mia Levine, PhD, další odpovídající autor studie. „Například děti starších otců mají tendenci mít delší telomery než děti mladších otců. Ale škádlení, proč k tomu dochází, je obtížné, protože studie člověka jsou zmateny tolika faktory – strava, kouření stresu, životního stylu. Proto jsme se obrátili na kontrolovaný zvířecí model, abychom tyto myšlenky přímo otestovali.“
Vědci zjistili, že délka telomer potomků nebyla průměrem délky telomer rodičů. Místo toho, když byly otcovské telomery dlouhé a mateřské telomery byly krátké, telomer embrya se rychle prodlužoval. V opačném kříži (dlouhý mateřský plus krátký otcov) se telomery zkrátily. Pokud měli oba rodiče podobné délky telomer, Telomeres zůstal stejný.

Tyto změny byly pozorovány velmi brzy. Rozdíly v délce telomery byly již přítomny ve dvoubuněčném stadiu embrya, než jsou vlastní geny embrya dokonce aktivní. To ukazuje, že účinek je vyvolán rodičovskými příspěvky, nikoli genomem embrya. Embrya, kde se telomery prodlužovaly, vykazovaly známky aktivity ALT, která byla spuštěna pouze tehdy, když došlo k neshodě v rodičovských délkách telomer. Bylo také poznamenáno, že rozdíl nebyl jen o délce telomer. Mateřské a otcovské chromozomy měly odlišné epigenetické značky, které nemění kód DNA, ale mohou ovlivnit to, jak se čte a používá, které se zdá, že ovlivňují, zda je ALT aktivován.
„Když lidé studují alt v rakovinných buňkách, již se to děje po mnoho generací,“ řekla Levine. „Ale v embryích můžeme při prvním iniciaci chytit Alt při prvních buněčných divizích. To nám dává okno, jak se tato cesta přirozeně zapne.“
To, že se jednalo o studii myši, by mohlo znamenat, že výsledky se plně nepřekládají na lidi, i když, jak řekl Levine, předchozí lidské údaje ukazují podobné vzorce rodičů původu. Dalším omezením je, že kontrolované šlechtění odstraňuje účinky na životní prostředí-věci, jako je stres a strava-, které by mohly ovlivnit telomery v nastavení skutečného světa.
Navzdory těmto omezením mají zjištění studie významné důsledky v reálném světě. Délka telomer je spojena se stárnutím a rakovinou. Vědět, jak je zděděn, by mohlo zlepšit predikci rizik za podmínky související s věkem. Dále, naučit se, jak kontrolovat délku telomer na začátku vývoje, by mohlo vést k novým přístupům pro regenerativní medicínu nebo ošetření plodnosti.
Dalším krokem vědců je zjistit, zda se jejich výsledky vztahují na lidi nebo ne.
„Na lidské straně nyní využíváme sekvenování genomu s dlouhým čtením,“ řekla Levine. „To nám umožňuje podívat se přímo na Telomery v rodinných triích-máma, táta a dítě-zeptat se, zda stejné účinky rodičů z původu, které jsme viděli u myší, jsou detekovatelné u lidí.“
Studie byla zveřejněna v časopise Současná biologie.
Zdroj: UPENN
Čerpáme z těchto zdrojů: google.com, science.org, newatlas.com, wired.com, pixabay.com