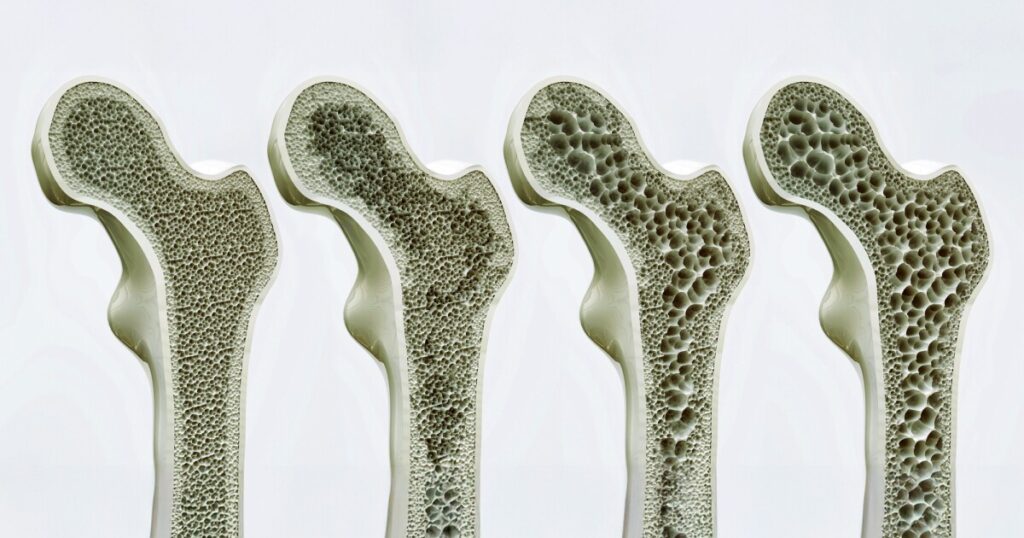
Nově objevený spínač receptoru, který zvyšuje růst kostí, by mohl transformovat způsob léčby osteoporózy stimulací vlastního stroje pro budování kostí pomocí cílené léčivo a dokonce i mechanické síly.
Osteovýbuchy jsou buňky vytvářející kosti. Osteoclastyna druhé straně, rozpusťte a rozbijte (resorb) staré nebo poškozené kostní buňky, takže prostor pro osteoblasty vytvářejí novou tkáň v oblastech, které rostou nebo potřebují opravu. Osteoporóza je výsledkem nerovnováhy mezi tvorbou kostí a resorpcí kostí.
Nová studie vedená University of Leipzig v Německu identifikovala kritický regulátor tvorby kostí, receptor proteinového proteinu G.
Růst kostí je očekávaně nejrychlejší během dětství a dospívání. Pak zpomaluje až do našich dvacátých let, kdy obvykle dosáhneme špičkové kostní hmoty. Poté má hustota kostí tendenci na plošinu po nějakou dobu, obecně po 50 letech, rozpad kostí začne překročit tvorbu kostí, což postupně snižuje hustotu kostí, jak stárneme.
Nalezeno na buněčných površích, receptory spojené s G proteinem (GPCR) lze považovat za molekulární spínače. Když se signalizační molekula váže na GPRC, aktivuje se G protein G, což zase spouští produkci libovolného počtu molekul druhého messengeru. Aktivace jediného G proteinu může ovlivnit produkci stovek nebo dokonce tisíců sekundových poslů, což ovlivňuje různé buněčné procesy a fyziologické funkce.
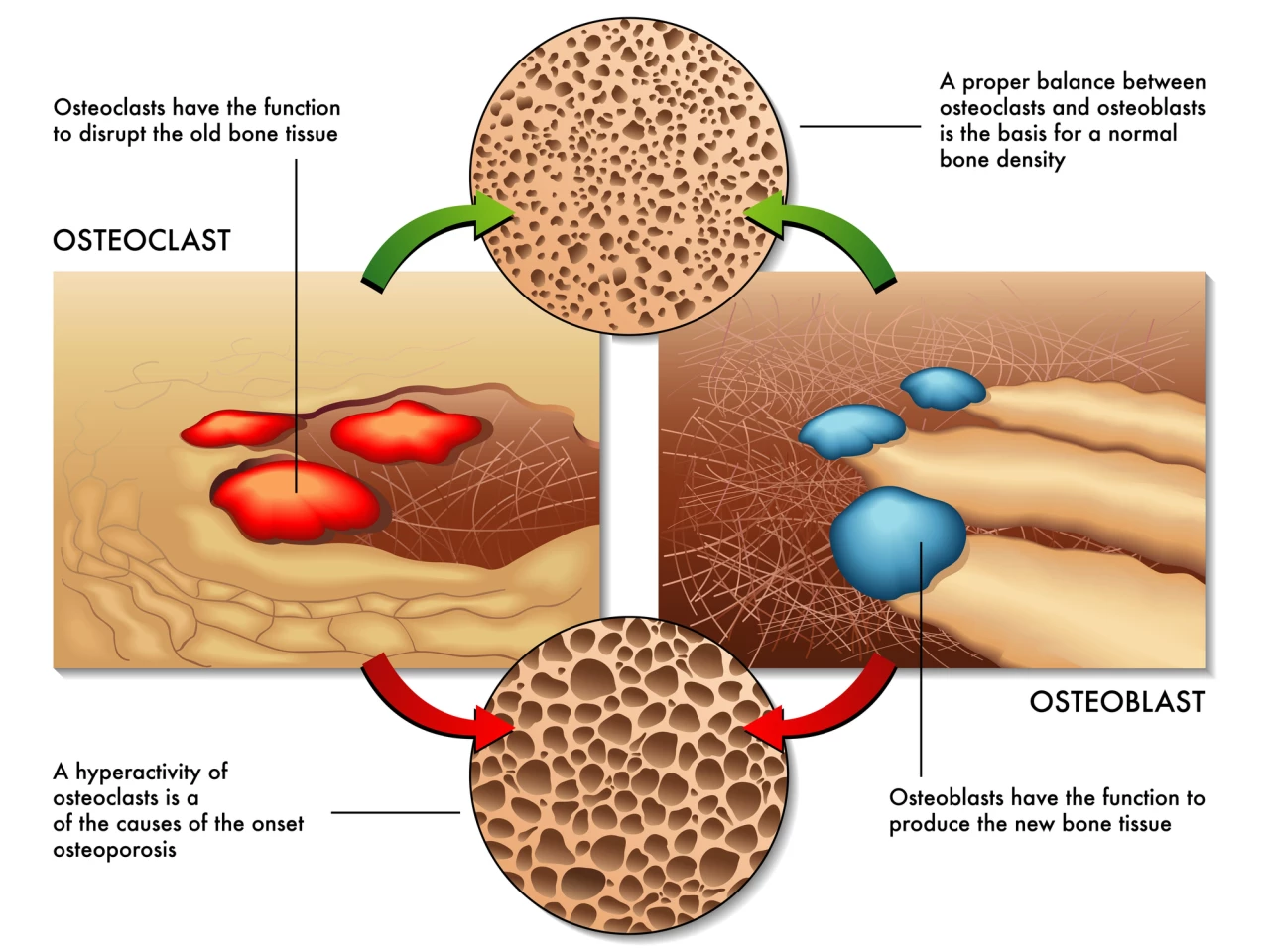
Předchozí výzkum identifikoval GPR133 jako potenciální genetický ovladač hustoty kostních minerálů (BMD) u lidí. BMD je měření množství minerálů, především vápníku a fosforu, v určitém objemu kosti, a je klíčovým ukazatelem zdraví kostí. Nízká BMD může zvýšit riziko zlomenin, zejména za podmínek, jako je osteoporóza. Přesná role GPR133 v homeostáze kosti není plně známa, takže vědci použili genetickou manipulaci, molekulární testy, mechanickou stimulaci a léčbu léčiva ke zkoumání molekulárních mechanismů, které jsou základem vlivu GPR133 na BMD
Knockoutové myši byly vytvořeny s genem GPR133 odstraněným buď v celém těle, nebo konkrétně v prekurzorových buňkách, které se diferencují na osteoblasty. Tyto myši se vyvinuly tenčí kosti, nižší BMD a zvýšenou resorpci kostí, napodobující osteoporózu. Studie využívající kmenové buňky odvozené z kosti a osteoblastových prekurzorových buněk ukázaly, že „vypnutí“ GPR133 znamenalo, že osteoblasty nefungovaly správně-nemohly také zrát nebo stavět kosti. Ale když byl gen aktivován, buňky produkovaly více diferenciačních markerů, proteiny, které nám říkají, že buňka zrání do plně fungujícího osteoblastu.
Při zkoumání signálních drah vědci zjistili, že GPR133 signály cesty-cyklický adenosin monofosfát (cAMP) a β-katenin-je známo, že jsou zásadní pro vývoj kostí, přestavbu a údržbu. Rovněž pozorovali, že aktivace GPR133 byla mechanosenzitivní, což znamená, že reagovala na simulovaný fyzický napětí v laboratorních testech, jako je protahování nebo zatížení. A interagoval s proteinem buněčného povrchu zvaný PTK7, „zvonek“, který předává zprávy mezi sousedními buňkami. Když se PTK7 vázá na GPR133, pomohl jej aktivovat; Společně měly PTK7 a mechanická síla synergický účinek, což zvyšovalo signál, který pomáhal osteoblastům zrající a správně fungoval.
Nakonec vědci testovali malou molekulovou lék AP503, který selektivně aktivuje GPR133. Zdravé myši a myši s nízkou BMD (osteopenie), které byly podávány denní injekce AP503, měly zvýšenou hustotu a pevnost kostí. Injekce zvrátily ztrátu kosti v myším modelu, který napodobuje postmenopauzální osteoporózu. Kombinace AP503 s cvičením vedla k synergickému účinku, což dále zvyšovalo tvorbu kostí.
„Pokud je tento receptor narušen genetickými změnami, myši vykazují příznaky ztráty hustoty kostí v raném věku – podobné osteoporóze u lidí,“ uvedl vedoucí autor studie, profesor Ines Liebscher, PhD, PhD, z Biochemického institutu Rudolfa Schönheimera. „Pomocí látky AP503, která byla teprve nedávno identifikována pomocí počítačové obrazovky jako stimulátor GPR133, jsme byli schopni výrazně zvýšit pevnost kostí u zdravých i osteoporotických myší.“
Předchozí studie vedená Leibscherem ve spolupráci s Shandong University v Číně již zjistila, že aktivace GPR133 pomocí AP503 posiluje kosterní sval.
„Nově prokázané paralelní posílení kosti opět zdůrazňuje velký potenciál, který tento receptor drží pro lékařské aplikace ve stárnoucí populaci,“ uvedla hlavní autorka Dr. Juliane Lehmann, také z Lippova biochemického institutu.

Používání pouze myších modelů je omezením této studie. I když jsou myši informativní, myši se liší od lidí z hlediska fyziologie kostí, takže translatace do klinického prostředí vyžaduje opatrnost. Dále, ačkoli byl AP503 prověřen na specificitu, dlouhodobou bezpečnost, potenciální účinky mimo cíl a to, jak lidské tělo ovlivňuje AP503 poté, co je podáno (farmakokinetika), zůstávají neznámé. A účinky aktivace GPR133 na jiné tkáně nebo tělesné systémy nebyly rozsáhle prozkoumány, což by mohlo být relevantní pro systémové ošetření.
Přes tato omezení však zjištění studie zdůrazňují některé potenciální aplikace v reálném světě. GPR133 je slibný terapeutický cíl, jehož aktivace s léky, jako je AP503, by mohla nabídnout novou třídu léčby osteoporózy, potenciálně s menším počtem vedlejších účinků než současné možnosti. Zjištění také otevírají dveře k personalizované medicíně. Někteří lidé přirozeně nesou mutace v GPR133, které je mohou předisponovat k osteoporóze. Screening těchto mutací by mohl identifikovat ohrožené jedince pro včasnou nebo preventivní léčbu.
Kromě léčby osteoporózy může mít GPR133 širší aplikace. Protože se také podílí na vývoji svalů, může to pomoci léčit plýtvání svaly nebo nehybně vyvolanou ztrátou kosti nebo dokonce u astronautů vystavené nulové gravitaci.
Studie byla zveřejněna v časopise Transdukce signálu a cílená terapie.
Zdroj: University of Leipzig
Čerpáme z těchto zdrojů: google.com, science.org, newatlas.com, wired.com, pixabay.com